 Biotechnologen entschlüsseln Struktur und Funktion von Docking Domänen bei der Biosynthese von Peptid-Wirkstoffen
Biotechnologen entschlüsseln Struktur und Funktion von Docking Domänen bei der Biosynthese von Peptid-WirkstoffenSusanne Sonntag
Frankfurt am Main (Weltexpresso) - Mikroorganismen bauen Naturstoffe oft wie am Fließband zusammen. Dabei spielen bestimmte Enzyme, die nicht-ribosomalen Peptid Synthetasen (NRPS), eine Schlüsselrolle. Biotechnologen der Goethe-Universität konnten jetzt aufklären, wie diese Enzyme untereinander wechselwirken. Damit kommen sie ihrem Ziel, maßgeschneiderte Peptid-Wirkstoffe zu synthetisieren, einen Schritt näher.
Viele wichtige Naturstoffe wie Antibiotika, Immunsuppressiva oder Mittel gegen Krebs stammen aus dem Stoffwechsel von Mikroorganismen. Diese Naturstoffe sind meistens kleine Eiweißmoleküle (Peptide), die in der Zelle mit Hilfe der NRPS-Enzyme wie in einer modernen Autofabrik entstehen: an jeder Station werden dem Grundgerüst weitere Teile zugefügt, bis am Ende das fertige Auto aus der Fabrik rollt. Im Fall der NRPS wird an jeder Station (genannt Modul) eine bestimmte Aminosäure eingebaut und prozessiert, so dass am Ende ketten-, ringförmige oder anders modifizierte Peptide entstehen, die auch ungewöhnliche Aminosäuren tragen können.
Sollen größere Peptide entstehen, kommen mehrere NRPS-Enzyme, also Fließbänder, nacheinander zum Einsatz. In welcher Reihenfolge dies geschieht, legen sogenannte Docking Domänen fest. Das sind kleine Bereiche am Ende des Fließbands, die wie Schlüssel und Schloss mit dem nächsten NRPS-Enzym in der Reihe zusammenpassen. Obwohl die grundlegenden Prinzipien dieser NRPS-Interaktion schon lange bekannt sind, war die Struktur der Docking-Domänen bisher nicht bekannt. Diese aufzuklären, ist den Arbeitsgruppen von Prof. Jens Wöhnert vom Institut für Molekulare Biowissenschaften und Prof. Helge Bode aus der Molekularen Biotechnologie an der Goethe-Universität nun gelungen.
„Wir konnten die Strukturen von einzelnen Docking Domänen und erstmals auch eines Docking Domänen Paars von NRPS bestimmen“, erläutert Carolin Hacker, Doktorandin in der Arbeitsgruppe von Jens Wöhnert. „So war es möglich, die Regeln für die Wechselwirkung der Docking-Domänen aufzuklären und diese so zu verändern, dass neue Naturstoffe gebildet werden“, fügt Xiaofeng Cai, Postdoktorandin in der Arbeitsgruppe von Helge Bode, hinzu.
„Unsere Arbeit steht erst am Anfang: Wir brauchen Strukturen weiterer und strukturell unterschiedlicher Docking-Domänen, um diese schließlich wie einen Baukasten zu verwenden. Unser Ziel ist es, verschiedene Biosynthesewege zu verknüpfen und so ganz neue Wirkstoffe herzustellen“, erklärt Wöhnert. „Die Natur war da sehr erfinderisch und es gibt offensichtlich viele unterschiedliche Möglichkeiten, diese komplexen Enzyme zur Zusammenarbeit zu überreden“, ergänzt Bode.
In beiden Arbeitsgruppen geht die Forschung auf diesem Gebiet also weiter. Erste Ergebnisse zu Strukturen weiterer Docking-Domänen sehen vielversprechend aus.
Foto:
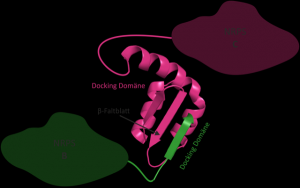
3D-Struktur eines NRPS Docking Domänen Paares. Die Docking-Domäne von NRPS B (grün) bindet über ein β-Faltblatt an die passende Docking-Domäne von NRPS C (magenta) © uni-frankfurt.de
Info:
Publikation:
Carolin Hacker, Xiaofeng Cai, Carsten Kegler, Lei Zhao, A. Katharina Weickhmann, Jan Philip Wurm, Helge B. Bode, Jens Wöhnert: Structure-based redesign of docking domain interactions modulates the product spectrum of a rhabdopeptide-synthesizing NRPS, Nature Communications, https://www.nature.com/ncomms/, DOI: 10.1038/s41467-018-06712-1
.

